염분
작성자
heukchoo
작성일
2021-03-29 23:12
조회
989
바닷물이 짠 이유는 염분 때문이다.
염분은 우리가 알고있는 소금과는 다르며, 소금(NaCl)과 함께 다양한 성분을 포함하고 있다.
염분의 정의
해수 1 ㎏ 속에 녹아있는 고형성분의 총량을 gram 수로 나타낸것
고형성분이란, 물(H2O) 이외의 성분으로서 해수를 증발시켰을 때 남아있는 고체 성분을 말한다.
* 오늘날 염분의 정식 단위는 psu 이지만 ‰(퍼밀, 천분위) 단위도 여전히 사용한다.
* 평균 염분은 35 psu 또는 35 ‰ 이다.
* 35 psu = 35 ‰ = 35 ppm = 3.5% .... (엄밀히는 단위에 따라 값의 차이가 있다. 아래 psu 단위 설명 참고)
염분의 농도
염분의 농도는 바닷물의 증발과 비나 강과 같은 담수의 유입으로 좌우된다.
증발량이 많으면 염분값이 높아지고 담수가 유입되면 희석되어 염분이 낮아진다.
강으로부터 멀리 떨어진 대양의 경우, 증발량과 강수량이 염분을 좌우한다.
또한, 증발량과 강수량은 해수의 표층에만 영향을 미치며, 심층은 대체로 염분이 일정하다.
* 증발량 > 강수량 = 고염분 // 증발량 < 강수량 = 저염분
위도별로 중위도는 무역풍의 영향으로 증발량이 많은 반면, 강수량이 적어 고염분(표층)을 보인다.
적도는 증발량에 비해 강수량이 높아 중위도에 비해 저염분을 보인다.
고위도는 증발량(증발량이 다른 위도에 비해 더욱 적음)에 비해 강수량이 높아 가장 저염분을 보인다.
대양의 염분 프로파일에서 표층의 혼합층은 염분이 일정하고 심해도 비교적 염분이 일정하다.
표층과 심해 사이의 중층에서는 염분 프로파일이 경사진 염분약층(Halocline)을 형성한다.
* 염분 < 25 psu 이면 기수(Brackish water)라 하고, 염분 > 40 psu 이면 고염수(Hypersaline)라 한다.
염분의 성분
염분의 대부분은 Cl-, Na+ 이다.
다음은 염분 주성분의 제원이다.
* 주성분은 염분의 대부분 양을 차지하고 있는 성분을 말한다.
해수에 녹아있는 주성분 원소들은 용해도가 높고, 반응성이 낮다.
지각중 최다 성분은 Si, Al, Fe로서 이들은 용해도가 낮고, 반응성이 높다.
* 반응성이 높다는 것은 반응하여 고체로 침전한다는 의미이다.
염분의 생성
최초의 바다는 맨틀에서 뿜어져 나온 가스 중 수증기가 응결하여 비로 내려서 형성되었다.
가스에는 Cl-, SO42- 등의 음이온이 많이 포함되어 있었고, 빗물에 녹아 비로 내렸다.
지각에는 Na+, Mg2+ 등의 양이온이 많이 포함되어 있었고, 빗물과 빗물의 음이온에 의해 씻겨지며 녹아나왔다.
이렇게 빗물에 포함된 음이온, 양이온이 염분의 주성분을 이룬다.
일정성분비의 법칙(Marcet's prineciple)
염분의 농도는 대양의 위치마다 다르지만 주성분의 상대조성(성분비)은 일정하다.
그러나 다음의 예외는 있다.
* 주성분 중 Ca2+, HCO3-, Mg2+는 생물에 의해 변동됨(CaCO3 패각을 형성하는 등)
* 열수지역은 Mg, Ca가 열수성분과 반응하여 침전
* 무산소(Anoxic) 또는 저산소(Suboxic) 지역에서 '황산염 환원 박테리아'가 황산염을 환원 시킴((SO42- → S2- + 2O2)
* 강에서 특정 성분의 유입, 과한 증발지역에서의 침전 반응
염의 순차적 침전(증발암 생성 순서)
석회암(CaCO3) → 석고(CaSO4) → 암염(NaCl) → 그 외 염(K, Mg 등)
* 침전 순서는 저용해도 → 고용해도 순서(고농도 → 저농도 순서가 아님)
* 침전 양은 석회암 < 석고 < 그 외 염 <<< 암염
염분 측정법
모어-크누센(Mohr-Knudsen) 적정법
* 가장 표준이 되는 염분 측정법으로 다른 염분 측정법의 보정에 사용된다.
* 정밀한 측정 법이지만 측정하기 번거롭고 시간이 소요된다.
* 지시약을 해수 시료에 넣고, 질산은을 조금씩 시료에 흘려 넣으면 질산은의 은과 해수 시료의 염소가 반응하여 백색의 침전물이 가라 앉는다.(염소는 해수 시료에서 제거되며 제거된 양은 흘려넣은 질산은 양과 같다.)
* 염소가 해수 시료에서 모두 제거되면 질산은의 은은 지시약과 반응하여 적갈색의 침전물을 형성한다. 이때, 질산은의 투입을 중단하고 이때까지 투입한 질산은의 양을 측정하면 대응되는 염소의 양을 측정할 수 있다.
* 질산은과 염소 반응식 : AgNO3 → Ag+ + NO3- // Ag+ + Cl- → AgCl (백색 침전물)
* 질산은과 지시약 반응식 : K2CrO4 → 2K+ + CrO42- // 2Ag+ + CrO42- → Ag2CrO4 (적갈색 침전물)
* 측정된 염소 농도로 일정성분비의 법칙을 이용해 염분을 계산한다. (S = 1.80655 × Cl)
굴절률 이용법
* 염분 농도가 높아질수록 변하는 굴절률을 굴절계를 이용하여 측정하고 상관식으로 염분을 계산
전기전도도법
* 현대의 염분측정 장비(CTD 등)가 사용하는 보편적 방식, 간단하고 빠른 방식으로 실시간 측정이 가능하다.
* 전기전도도(Conductivity)는 전기저항과 '역'의 관계로 전기가 잘 통하는 정도를 의미하며, 단위는 전기저항 단위인 Ω(ohm)을 뒤집은 ℧(mho)를 사용한다.
* 염분이 증가할수록 해수의 전기전도도는 증가하는 상관관계를 이용한 측정법이다.
* 전기전도도비(K15) = 해수시료의 전도도/ 표준 KCl 용액의 전도도 (조건: 섭씨 15 도, 1기압)
* 표준 KCl 용액은 1kg의 물에 KCl 32.4356g을 녹인 용액으로 염분 35의 표준해수의 전기전도도와 같은 값을 가지는 KCl 용액을 만든 것이다.
* KCl 용액의 전기전도도 값은 이미 측정되어 정해져 있으니 해수 시료의 전기전도도만 측정하면 시료의 K15를 쉽게 계산할 수 있고 K15와 염분간의 상관관계 식(이미 많은 실험으로 완성된)에 대입하여 염분값을 간단히 얻을 수 있다.
염분의 단위 psu
psu(practical salinity unit)는 실용염분단위라고 읽는다.
psu는 전기전도도법의 측정법에 의해 탄생한 단위이다.
K15의 계산 과정에서 전기전도도의 단위가 서로 나눠져 사라지기 때문에(무차원) 염분은 무차원이 된다. 즉, %, ‰과 같은 농도의 의미도 없다.
전기전도도법으로 계산된 35라는 값 뒤에 아무것도 안붙이면 의미를 알 수 없기 때문에 염분 값이라는 의미로서 psu를 표시하는 것이다.(엄밀히는 단위도 아님)
하지만 35 psu는 평균 염분인 35 ‰과 맞춘 것이고 K와 염분의 상관관계에서 psu 와 ‰이 약간의 오차가 있다고 해도 ‰에 대응하는 값을 psu로 칭한 것이기 때문에, 엄밀한 경우가 아니면 일반적으로 psu = ‰ 로 생각해도 무방하다.
염분은 우리가 알고있는 소금과는 다르며, 소금(NaCl)과 함께 다양한 성분을 포함하고 있다.
염분의 정의
해수 1 ㎏ 속에 녹아있는 고형성분의 총량을 gram 수로 나타낸것
고형성분이란, 물(H2O) 이외의 성분으로서 해수를 증발시켰을 때 남아있는 고체 성분을 말한다.
* 오늘날 염분의 정식 단위는 psu 이지만 ‰(퍼밀, 천분위) 단위도 여전히 사용한다.
* 평균 염분은 35 psu 또는 35 ‰ 이다.
* 35 psu = 35 ‰ = 35 ppm = 3.5% .... (엄밀히는 단위에 따라 값의 차이가 있다. 아래 psu 단위 설명 참고)
염분의 농도
염분의 농도는 바닷물의 증발과 비나 강과 같은 담수의 유입으로 좌우된다.
증발량이 많으면 염분값이 높아지고 담수가 유입되면 희석되어 염분이 낮아진다.
강으로부터 멀리 떨어진 대양의 경우, 증발량과 강수량이 염분을 좌우한다.
또한, 증발량과 강수량은 해수의 표층에만 영향을 미치며, 심층은 대체로 염분이 일정하다.
* 증발량 > 강수량 = 고염분 // 증발량 < 강수량 = 저염분
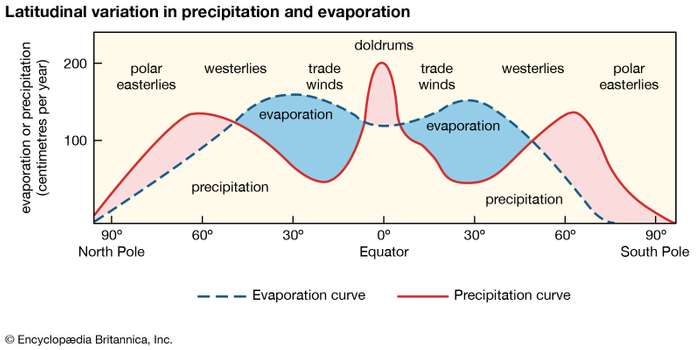
위도별로 중위도는 무역풍의 영향으로 증발량이 많은 반면, 강수량이 적어 고염분(표층)을 보인다.
적도는 증발량에 비해 강수량이 높아 중위도에 비해 저염분을 보인다.
고위도는 증발량(증발량이 다른 위도에 비해 더욱 적음)에 비해 강수량이 높아 가장 저염분을 보인다.
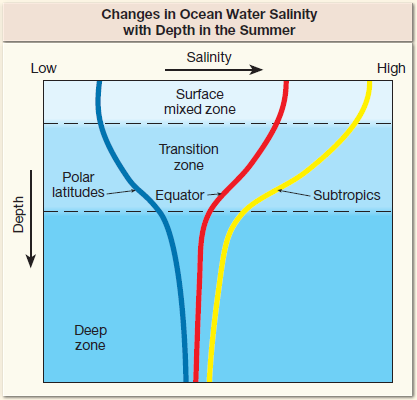
대양의 염분 프로파일에서 표층의 혼합층은 염분이 일정하고 심해도 비교적 염분이 일정하다.
표층과 심해 사이의 중층에서는 염분 프로파일이 경사진 염분약층(Halocline)을 형성한다.
* 염분 < 25 psu 이면 기수(Brackish water)라 하고, 염분 > 40 psu 이면 고염수(Hypersaline)라 한다.
염분의 성분
염분의 대부분은 Cl-, Na+ 이다.
다음은 염분 주성분의 제원이다.
* 주성분은 염분의 대부분 양을 차지하고 있는 성분을 말한다.
| 성분 | 비율(%) | 질량(mg/kg) | 체류시간(yr) |
| Cl- | 55.0 | 18,980 | 100,000,000 |
| Na+ | 30.6 | 10,560 | 68,000,000 |
| SO42- | 7.7 | 2,560 | 11,000,000 |
| Mg2+ | 3.7 | 1,272 | 13,000,000 |
| Ca2+ | 1.2 | 400 | 1,000,000 |
| K+ | 1.1 | 380 | 12,000,000 |
해수에 녹아있는 주성분 원소들은 용해도가 높고, 반응성이 낮다.
지각중 최다 성분은 Si, Al, Fe로서 이들은 용해도가 낮고, 반응성이 높다.
* 반응성이 높다는 것은 반응하여 고체로 침전한다는 의미이다.
염분의 생성
최초의 바다는 맨틀에서 뿜어져 나온 가스 중 수증기가 응결하여 비로 내려서 형성되었다.
가스에는 Cl-, SO42- 등의 음이온이 많이 포함되어 있었고, 빗물에 녹아 비로 내렸다.
지각에는 Na+, Mg2+ 등의 양이온이 많이 포함되어 있었고, 빗물과 빗물의 음이온에 의해 씻겨지며 녹아나왔다.
이렇게 빗물에 포함된 음이온, 양이온이 염분의 주성분을 이룬다.
일정성분비의 법칙(Marcet's prineciple)
염분의 농도는 대양의 위치마다 다르지만 주성분의 상대조성(성분비)은 일정하다.
그러나 다음의 예외는 있다.
* 주성분 중 Ca2+, HCO3-, Mg2+는 생물에 의해 변동됨(CaCO3 패각을 형성하는 등)
* 열수지역은 Mg, Ca가 열수성분과 반응하여 침전
* 무산소(Anoxic) 또는 저산소(Suboxic) 지역에서 '황산염 환원 박테리아'가 황산염을 환원 시킴((SO42- → S2- + 2O2)
* 강에서 특정 성분의 유입, 과한 증발지역에서의 침전 반응
염의 순차적 침전(증발암 생성 순서)
석회암(CaCO3) → 석고(CaSO4) → 암염(NaCl) → 그 외 염(K, Mg 등)
* 침전 순서는 저용해도 → 고용해도 순서(고농도 → 저농도 순서가 아님)
* 침전 양은 석회암 < 석고 < 그 외 염 <<< 암염
염분 측정법
모어-크누센(Mohr-Knudsen) 적정법
* 가장 표준이 되는 염분 측정법으로 다른 염분 측정법의 보정에 사용된다.
* 정밀한 측정 법이지만 측정하기 번거롭고 시간이 소요된다.
* 지시약을 해수 시료에 넣고, 질산은을 조금씩 시료에 흘려 넣으면 질산은의 은과 해수 시료의 염소가 반응하여 백색의 침전물이 가라 앉는다.(염소는 해수 시료에서 제거되며 제거된 양은 흘려넣은 질산은 양과 같다.)
* 염소가 해수 시료에서 모두 제거되면 질산은의 은은 지시약과 반응하여 적갈색의 침전물을 형성한다. 이때, 질산은의 투입을 중단하고 이때까지 투입한 질산은의 양을 측정하면 대응되는 염소의 양을 측정할 수 있다.
* 질산은과 염소 반응식 : AgNO3 → Ag+ + NO3- // Ag+ + Cl- → AgCl (백색 침전물)
* 질산은과 지시약 반응식 : K2CrO4 → 2K+ + CrO42- // 2Ag+ + CrO42- → Ag2CrO4 (적갈색 침전물)
* 측정된 염소 농도로 일정성분비의 법칙을 이용해 염분을 계산한다. (S = 1.80655 × Cl)
굴절률 이용법
* 염분 농도가 높아질수록 변하는 굴절률을 굴절계를 이용하여 측정하고 상관식으로 염분을 계산
전기전도도법
* 현대의 염분측정 장비(CTD 등)가 사용하는 보편적 방식, 간단하고 빠른 방식으로 실시간 측정이 가능하다.
* 전기전도도(Conductivity)는 전기저항과 '역'의 관계로 전기가 잘 통하는 정도를 의미하며, 단위는 전기저항 단위인 Ω(ohm)을 뒤집은 ℧(mho)를 사용한다.
* 염분이 증가할수록 해수의 전기전도도는 증가하는 상관관계를 이용한 측정법이다.
* 전기전도도비(K15) = 해수시료의 전도도/ 표준 KCl 용액의 전도도 (조건: 섭씨 15 도, 1기압)
* 표준 KCl 용액은 1kg의 물에 KCl 32.4356g을 녹인 용액으로 염분 35의 표준해수의 전기전도도와 같은 값을 가지는 KCl 용액을 만든 것이다.
* KCl 용액의 전기전도도 값은 이미 측정되어 정해져 있으니 해수 시료의 전기전도도만 측정하면 시료의 K15를 쉽게 계산할 수 있고 K15와 염분간의 상관관계 식(이미 많은 실험으로 완성된)에 대입하여 염분값을 간단히 얻을 수 있다.
염분의 단위 psu
psu(practical salinity unit)는 실용염분단위라고 읽는다.
psu는 전기전도도법의 측정법에 의해 탄생한 단위이다.
K15의 계산 과정에서 전기전도도의 단위가 서로 나눠져 사라지기 때문에(무차원) 염분은 무차원이 된다. 즉, %, ‰과 같은 농도의 의미도 없다.
전기전도도법으로 계산된 35라는 값 뒤에 아무것도 안붙이면 의미를 알 수 없기 때문에 염분 값이라는 의미로서 psu를 표시하는 것이다.(엄밀히는 단위도 아님)
하지만 35 psu는 평균 염분인 35 ‰과 맞춘 것이고 K와 염분의 상관관계에서 psu 와 ‰이 약간의 오차가 있다고 해도 ‰에 대응하는 값을 psu로 칭한 것이기 때문에, 엄밀한 경우가 아니면 일반적으로 psu = ‰ 로 생각해도 무방하다.
전체 0